
- Matéria e Energia --> Joaquim
- Átomos Moléculas e Íons --> Mauro
- Soluções e Concentração --> Rodrigo
- Reações Químicas -->
Quando fervemos água, qual o estado físico do que vemos sair dela? Adianta aumentar a chama para elevar a temperatura?
Em família, a professora Tânia responde a essas e outras perguntas, proporcionando uma viagem fascinante, cheia de descobertas científicas, a Carlos Eduardo, seu marido, e à sua filha - a pequena e curiosa Júlia.
Conceitos desta aula: Caracterizar e diferenciar matéria e energia
Compreender as diferenças entre os três estados físicos da matéria
Fazer a distinção entre as diferentes formas de energia
Conceituar calor e temperatura
-------------------------------------------------------------------------------------------------------------------------------------------------------------------
CENA 1 (Colégio
Vicente Telles - sala da diretora)
Personagens:
Diretora Ana Maria
Profa. Tânia Cristina
Ilustrações:
1 - Sala da diretora: quadro de avisos ao fundo com alguns bilhetes fixados; mesa de escritório com alguns papéis dispostos sobre a mesa de maneira organizada e um copo d'água com metade do volume preenchido; porta da sala entreaberta; janela aberta. Tânia, em pé, e a diretora, sentada à mesa, conversam. Tânia ainda segura o livro-texto adotado pela escola e uma caixinha de madeira com giz e apagador. Na capa do livro é possível ler o título CIÊNCIAS e ver uma ilustração do planeta Terra.

Diretora: Tânia, que bom que você veio logo! Preciso de sua ajuda... A Secretaria de Educação determinou que as escolas criem um projeto pedagógico inovador do ensino de Ciências para crianças e pré-adolescentes. O objetivo da Secretaria é alfabetizar nossas crianças em Ciências logo nas primeiras séries, fazendo com que elas despertem o prazer pela descoberta e se sintam motivadas a questionar os diversos fenômenos químicos e físicos ao seu redor, buscando explicações para eles. Eu chamei-a aqui porque gostaria que você ficasse responsável por montar esse projeto na área de Química.
Tânia: Química para crianças e pré-adolescentes?! Isso me parece uma tarefa impossível, considerando o desinteresse dos alunos pela disciplina. Não tenho a mínima idéia de como um projeto assim possa ser desenvolvido!
Diretora: Mas é bom você começar a pensar nisso... A Secretaria vai liberar uma verba extra para as escolas que criarem seus projetos. Com essa verba, será possível reformar algumas salas de aula e talvez montar aquela sala de informática que há tempos estou querendo. Por falar em informática, será que algum curso daqueles que você fez pela internet pode ser aproveitado na elaboração desse projeto?
Tânia: Não sei não, Ana... Nem imagino por onde começar... Você me pegou de surpresa!
Diretora: Bem, vá para casa e pense um pouco. Preciso de um esboço desse projeto na semana que vem.
Tânia (rindo): Pensar sobre isso em casa! Isso me parece mais difícil que montar o próprio projeto. Tenho que preparar o jantar do Carlos e da Júlia, depois calcular e lançar as notas das turmas nos diários... Nem sei a que horas vou dormir hoje.
Diretora: Tânia, o colégio está precisando dessa verba e contamos com você pra isso. Eu tenho certeza de que você vai preparar um projeto caprichado!
------------------------------
CENA 2 (Casa
da Tânia - cozinha)
Personagens:
Tânia
Carlos Eduardo
Júlia
Ilustrações:
1 - Vista interna da cozinha da casa da Tânia. Tânia, encostada na pia com alguns legumes sobre a bancada, conversa com Júlia e Carlos, que acabaram de chegar da rua. No fogão, uma panela de pressão fumegando chama a atenção de Júlia. Julia, entre a mãe e o fogão, chupa um picolé de manga. Carlos está em pé ao fundo, próximo à porta de entrada da cozinha.
Tânia: Olá, querida! Não acredito que seu pai te deu picolé antes do jantar. Depois você não vai comer...
Carlos: Está tão quente hoje... Deixa a menina se refrescar um pouco.
Tânia: Acho que eu é que vou colocar um picolé na minha cabeça pra ver se refresca um pouco.
Carlos: Estou achando você tensa... O que aconteceu?
Tânia: A louca da Ana Maria me pediu - pra semana que vem! - um projeto "inovador" de ensino de Química pra crianças e pré-adolescentes. De onde eu vou tirar isso?
Carlos: Não entre em desespero, querida... Tenho certeza de que você vai pensar em algo muito bom.
Júlia: Mãe, o que vamos comer hoje?
Tânia: Uma deliciosa sopa, com todos os legumes que você adora. Cuidado com a panela no fogo!
Júlia: Para fazer sopa precisa dessa fumacinha?
Tânia: Essa fumacinha que está saindo da panela indica que há vapor d'água saindo.
Júlia: Ah... Eu aprendi na escola que quando a gente esquenta água ela vira vapor, e quando a gente coloca no freezer ela vira gelo. Por isso o picolé fica gelado!
Carlos (provocando): Então a água pode ser líquida, gelo ou vapor?
Júlia: Isso mesmo, pai!
Tânia: Mas ela deixa de ser água quando vira gelo ou quando vira vapor?
Júlia: Claro que não, né, mãe! Até parece que você não sabe isso! Gelo é água, vapor é água, e água é água!
Carlos (rindo): Ah, essa foi boa! A menina tá sabendo tudo de água!
Tânia: Ah, sua sabichona... Chega de papo e vá pro chuveiro agora mesmo. Você é quem está precisando de muita água para ficar limpa pro jantar!
Júlia: Tá bom, mãe... Já tô indo...
Carlos: Querida, então essa fumaça branca é vapor d'água?
Tânia: Na verdade, não!
Carlos: Mas tudo mundo fala que é. Até no noticiário, quando mostram um
chaminé com fumaça branca, dizem que é vapor ou sei lá o quê.
Tânia: O vapor d´água é invisível. Essa fumacinha que você vê saindo da panela já é água condensada, líquida, dispersa no ar. Nós somos induzidos da presença do vapor pela existência destas gotículas de água suspensas. Elas foram condensadas no próprio ar devido ao resfriamento da temperatura do vapor com o ambiente.
Carlos: Puxa, que bonito isso!Carlos: Então, todo vapor é invisível?
Tânia: Não necessariamente. O vapor da água, assim como o CO2, é invisível porque a água absorve apenas na região do ultra-violeta, que não pode ser captado por nossos olhos. Já os vapores de I2 ou Br2, por exemplo, são coloridos, roxo e laranja, respectivamente. A lâmpada de vapor de sódio, essa em frente à nossa casa, é laranja.
------------------------------
CENA 3 (Casa da Tânia - sala de
estar)
Personagens:
Tânia
Carlos Eduardo
Ilustrações:
1 - Vista interna da sala de estar da casa da Tânia, mais precisamente da mesa de jantar de quatro lugares, com uma panela no centro, fumegando um pouco, e três lugares com pratos e talheres. Tânia e Carlos arrumam a mesa enquanto conversam.

Carlos: Ih... Lá vem você com esse palavreado!
Tânia: Mas que palavreado?
Carlos: Esse quimiquês... Estados físicos da matéria... (ri).
Tânia: Ao menos você sabe o que é matéria?
Carlos: Claro! Matéria vem do latim materea, e significa "aquilo do que é feito". Então, por exemplo, a matéria de uma reunião é o teor daquela reunião, ou o conteúdo que se quer expor.
Tânia: Para a Química não é muito diferente. Quando perguntamos sobre qual a matéria de um objeto, no fundo queremos entender do que ele é composto, quais são os elementos que o constituem. Mas o que é matéria em si é um pouco mais complicado. Uma definição usual e bastante aceita é que "matéria é tudo aquilo que possui massa e ocupa lugar no espaço". Ao menos para o nosso dia-a-dia, esta definição é suficiente. Matéria é tudo que está ao nosso redor: o ar, um pedaço de folha de papel, um clipe...Carlos: E o calor desta panela, é matéria?
Tânia: O calor não! O calor, na verdade, é o nome que damos à
transferência de energia térmica. Mas para a energia térmica transferir-se,
ela precisa de matéria. O calor é uma manifestação da diferença de temperatura
entre os corpos, ou, se você preferir, entre matérias. Mas agora
vamos jantar, senão a sopa esfria e você vai dizer que a culpa é da
Química!
------------------------------
CENA 4 (Casa da Tânia - sala de
estar)
Personagens:
Tânia
Carlos Eduardo
Ilustrações:
Close na água, gelo e vapor da panela.
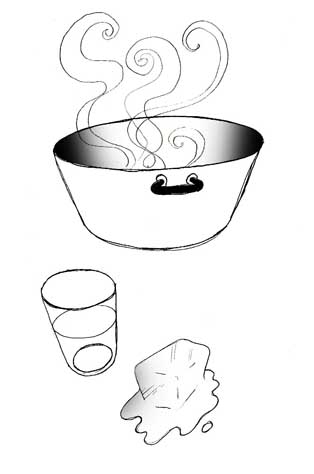
Tânia: Puxa vida... Mas essa menininha gosta de brincar! Ainda bem que ela já foi dormir.
Carlos: Querida, estou lendo este livro sobre filosofia da natureza, e lembrei do que conversamos sobre matéria no jantar. Olha o que ele diz aqui: “Substância é uma palavra que quer dizer ‘o que está embaixo’, ou seja, é o que permanece debaixo das aparências e dos fenômenos”*. Esta não seria uma boa definição para matéria?
Tânia: Não sei, talvez… Às vezes, usamos os termos "matéria" e "substância" como sendo sinônimos, mas na verdade substância é uma forma pura da matéria, como o ouro e a água. Um bloco de cimento, por exemplo, que é resultado de uma combinação de várias substâncias, não pode ser chamado de “substância” e sim “mistura”. Cimento é uma mistura de substâncias e não deixa de ser matéria por causa disto. O mesmo ocorre com o ar. O ar é composto de vários gases: oxigênio, nitrogênio etc; então ele é uma mistura. Tanto os gases que compõem o ar isoladamente como o próprio ar são matéria (de composições distintas), já que possuem massa e ocupam espaços vazios.
Carlos: Tudo bem, mas vamos voltar àquela história da água, do gelo e do vapor. É tudo a mesma substância água, independente da aparência?
Tânia: Claro, porque as substâncias e as misturas, de forma geral, existem na natureza em diferentes formas, chamadas "estados físicos da matéria". A água não se transforma em outra substância quando vira gelo ou vapor; não ocorre qualquer quebra entre as ligações Químicas desta molécula, ela permanece sendo a boa e velha água. O que ocorre nesse caso é apenas uma mudança de estado físico.
Carlos: Se gelo e vapor d'água não são substâncias diferentes, o que diferencia os estados físicos da água?
Tânia: A diferença está no grau de associação das moléculas de água.
Levanta e vem ver esta figura aqui.
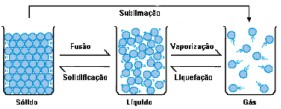
Tânia: Veja que, no estado sólido, deve existir maior aproximação entre as moléculas da substância, tornando o estado sólido uma estrutura rígida. No estado líquido, a associação entre as moléculas de água é menor; isso leva a uma forma fluida da matéria, que toma a forma do recipiente no qual ela está inserida. No estado gasoso, as moléculas estão mais dispersas ainda e viajam mais livremente, ocupando de forma homogênea todo o recipiente.
Carlos: Então, quando as moléculas de água se afastam entre si, ela vira um gás?
Tânia: É isso aí! Utilizamos o termo "vapor" para designar uma substância que passou ao estado gasoso mas que, à temperatura ambiente, não se encontra nesse estado. Por isso falamos, por exemplo, em vapor de água e gás oxigênio. À temperatura ambiente, a água é líquida e o oxigênio é gasoso.
Carlos: Você quer dizer que a mudança de estado físico não altera a composição da matéria, ou seja, a substância é a mesma... O que muda é a sua aparência...
Tânia: Claro! Uma mesma substância pode estar em três estados físicos distintos, passando de um a outro. Essa mudança de estado não altera as propriedades químicas da matéria. A água continua sendo água no estado sólido, líquido ou gasoso. O que mudou foi apenas o estado de agregação das moléculas. Ocorreu apenas um fenômeno físico; nele não há alteração da estrutura nem da constituição da matéria. No entanto, a constituição e/ou estrutura da matéria podem ser alteradas, se ocorrer uma transformação química.
Carlos: Transformação química! Agora a coisa começou a ficar interessante!
Tânia: Por exemplo: quando queimamos um pedaço de madeira ou riscamos um palito de fósforo, aí estão ocorrendo transformações químicas. Os produtos dessas transformações são substâncias com estrutura e constituição diferentes daquelas das substâncias que compõem o pedaço de madeira, por exemplo. Nesse caso ocorreu um fenômeno químico. E a maioria das transformações químicas vem acompanhada de uma troca de energia.
Carlos: Ih, você se empolgou agora! Deixa eu continuar aqui na minha filosofia que você tem de terminar esses diários!
------------------------------
CENA 5 (Casa da Tânia - sala de
estar)
Personagens:
Tânia
Carlos Eduardo
Júlia
Ilustrações:
1 - Vista interna da cozinha da casa da Tânia. Tânia próxima ao fogão prepara o almoço da família. Carlos Eduardo chega com Júlia do colégio. Júlia está de mochila e uniforme da escola (Colégio Vicente Telles). No fogão há várias panelas (uma delas é uma panela de pressão fumegando - cozinhando feijão). Carlos está em pé ao fundo, próximo à porta de entrada da cozinha.

Júlia: Mãe, mãe, tenho que te contar o que a minha professora falou hoje! Ela disse que no mar, além dos peixes, golfinhos, baleias e camarões, tem também bactéria! Eu achava que bactéria só existia em coisas sujas, mas se ela vive na água, não pode ser só em coisa suja, pode?
Tânia: Não, minha filha. As bactérias não vivem só em coisas sujas não, vivem em quase tudo quanto é lugar! Tem bactéria que até ajuda a limpar lugares sujos, como acontece no mar, quando às vezes ocorre derramamento de petróleo. Você não se lembra da notícia que deu na televisão um dia desses? Você ficou impressionada ao ver aquela garça toda suja de petróleo! Bem que podia ter uma bactéria que limpasse o suco que você vive derramando no tapete!
Júlia: E sabe o que mais ela disse? Que no fundo do mar tem bactérias e animais que vivem em umas fontes de água quente, mais quente que a água fervendo para cozinhar o feijão!
Carlos: Ah... Isso é mentira! A água sempre ferve a 100oC em qualquer lugar do mundo!
Tânia: Desculpe querido, mas a professora da Júlia está certa: a água não ferve só a 100oC. Você se lembra quando ontem te mostrei aquela figura com os diferentes estados de agregação da água? Então... Quando a água passa de líquido para vapor, ocorre o que chamamos de ebulição. Foi medido que 100oC é a temperatura de ebulição da água no nível do mar... Na verdade, esse é o ponto de ebulição da água na escala de temperatura que chamamos de Celsius. Mas essa temperatura de ebulição depende da pressão exercida sobre o conjunto de moléculas de água que está sendo aquecido. O mesmo vale para o ponto de fusão da água, que é a temperatura em que o gelo se funde, ou seja, passa para o estado líquido. Na escala Celsius, essa temperatura foi definida como sendo 0oC. Mas, sob diferentes pressões, essas mudanças de fase (ou mudanças de estado físico) ocorrem em temperaturas diferentes.
Júlia: Ih... Que coisa complicada!
Tânia: Olha só, lembra daquele brinquedo em que o palhaço sai de dentro de uma caixa? Imagina se eu ponho uma pedra em cima... Fica mais difícil para o palhaço sair... Se colocar uma pedra mais pesada, fica mais dificil ainda... A pressão do ar é como se fosse essa pedra: no alto de uma montanha, como o ar é mais rarefeito, a pressão que ele exerce sobre a água é menor, facilitando a passagem de moléculas de água do estado líquido para o gasoso. Então, lá na casa da vovó, em Teresópolis, a água entra em ebulição a uma temperatura menor que aqui no Rio, já que Terê está a uns 900 metros acima do nível do mar.
{Inserir ilustração-jogo do palhaço}
Júlia: Ah... Acho que agora entendi melhor...
Carlos: Querida, por que você não aumenta esse fogo para essas batatas cozinharem mais rápido?
Tânia: Porque não vão cozinhar mais rápido, não. A batata cozinha na água fervente, isto é, na água que está à temperatura de ebulição. Durante a mudança de estado físico (ebulição ou fusão) existe equilíbrio entre as fases envolvidas, e o mais interessante é que a temperatura permanece constante! Então, aumentar o fogo só vai aumentar a conta do gás, mais nada!
Carlos: Não acreditei muito nisso, não, mas se você está dizendo...
Júlia: Ai, mãe, tô com fome... Deixa esse papo pra depois e prepara meu almoço! E já que você falou de gelo, posso chupar um picolé?
Tânia: Só depois do almoço! Agora, já pra debaixo do chuveiro! Enquanto isso, vou mostrar para o seu pai meu caderno com os diagramas de fase de uma substância! Ele vai ver que o que eu eu falei está certo, e também que, sob determinadas condições de temperatura e pressão, os três estados físicos podem coexistir. É o que chamamos ponto triplo!
Carlos: Ai, pra quê que eu fui abrir minha boca... Ponto triplo parece coisa de loteria ou jogo de tênis! (ri)
(nota 2 do caderno)
------------------------------
CENA 6 (Casa da Tânia - sala de
estar)
Personagens:
Tânia
Carlos Eduardo
Ilustrações:
1 - Vista interna da sala de estar da casa da Tania. Carlos e Tânia conversam sentados no sofá.

Carlos: Interessante aquela analogia que você usou para explicar a influência da pressão sobre a ebulição da água. Será que você pode comparar a força necessária para abrir a caixa do palhaço com o calor necessário para fazer a água ferver sob diferentes condições de pressão?
Tânia: Acho que essa não é uma boa comparação... O calor é uma transferência de energia térmica que ocorre entre objetos com diferentes temperaturas, mas não há a realização de trabalho mecânico, ao contrário do que acontece na abertura da caixa. A gente nem pode dizer que um objeto tem mais calor que outro, porque calor mesmo é só a transferência dessa energia. Ou seja, é uma manifestação da diferença de temperatura entre os corpos.
Carlos: Acho que isso seria um bom exemplo do que o Bachelard chamava de obstáculo epistemológico... Às vezes tentamos simplificar o ensino com metáforas e analogias e a razão acaba se acomodando a elas. Às vezes induz mesmo ao erro, ao invés de buscar superar a dificuldade inerente de aprender! Mas o calor é só transferência de energia? Não tem transferência de átomos, moléculas ou vapores?
Tânia: Não, não há nenhuma transferência de massa. Durante muito tempo se acreditou que existisse uma coisa chamada calórico, um fluido invisível que seria transferido entre os objetos de diferentes temperaturas. Enfim, o calor é energia térmica em trânsito! O calor pode ser medido e quantificado em calorias ou em joules. Uma quilocaloria (kcal) corresponde ao calor necessário para aumentar em um grau Celsius a temperatura de um quilograma de água. Qualquer livro de Física tem o fator de conversão de caloria pra joules: 1 cal = 4,184 joules.
Carlos: Mas eu achava que o calor era medido pela temperatura... Sempre que a moça do tempo aparece na televisão, ela diz que vai fazer calor e que a temperatura vai aumentar...
Tânia: A temperatura é uma medida da energia cinética das moléculas que compõem um sistema, lembra-se?. ..
Carlos: Energia cinética? Argh!
Tânia: Bem, vamos do começo...
Energia é definida como a capacidade
de realizar trabalho, como levantar um peso ou forçar
uma corrente elétrica através de um circuito. Então, quanto maior for a
energia de um objeto, maior será a sua capacidade de gerar
trabalho. Existem duas formas
importantes de energia: a energia cinética e a energia potencial. A energia
cinética está associada ao movimento de
um corpo. Bom, já que você é
matemático e gosta de fórmulas, vejamos as deste livro: para um corpo
de massa m e velocidade v, a energia cinética
(Ec) é calculada assim:
Ec = ½ mv2
Carlos: Como matemático, de fórmulas eu entendo! Mas você não tem um
exemplo, digamos, mais concreto?
Tânia: Tenho sim. Olha só, um caminhão tem maior capacidade de gerar
trabalho que uma bicicleta se ambos estiverem à mesma velocidade. E mais:
dois caminhões idênticos geram diferentes quantidades de trabalho, se
estiverem em velocidades diferentes.
Carlos: E a outra energia, como era mesmo o nome?
Tânia: A energia potencial representa a energia que um corpo possui que é
dependente das forças que atuam sobre ele. Sendo assim, não há expressão
matemática que a represente. Mas dá pra pensar em um caso simples.
Imagine um corpo de massa m a uma altura h sobre a
superfície da Terra. Ele possui energia potencial: ela depende da sua massa,
da altura em que está e da aceleração da gravidade, que é representada por
g. Então, a equação da energia potencial nesse caso será:
Ep = mgh
Então, quanto maior for a altura h, maior será o valor da
energia potencial. Outro tipo de energia potencial muito importante em
Química é a que ocorre envolvendo duas partículas carregadas
eletricamente, por exemplo, q1 e
q2. Nesse caso, a energia potencial é proporcional à
distância r entre elas, ou seja:
Ep =
(q1q2)/r {{não é igual, é proporcional}}
Esteban, achei esta animação fantástica, mas pelo
q entendi, é protegida por copyright. O Marco n poderia criar uma no mesmo
estilo? Poderia mostrar q o "macaco" (força externa) está realizando
trabalho para aproximar as duas cargas +. Daria pra fazer tb uma com as
cargas opostas! pensei agora numa analogia meio doida, mas poderia ser uma
bola de futebol (+) sendo levada por um jogador para o goleiro do
mesmo time dele (+) (a repulsão evita o gol contra...rs..) e para o goleiro
do time adversário (-) (a atração evita o gol..rs...)
Com isso, quando duas partículas com carga estão infinitamente
separadas, o valor r é muito grande; aí podemos considerar que a
energia potencial é nula. Se duas cargas possuem o mesmo sinal,
como dois prótons, o numerador é positivo e a energia potencial aumenta
à medida que a distância entre eles diminui. De forma oposta, se duas cargas
possuem sinais opostos, como um próton e um elétron, o numerador é
negativo e a energia potencial se reduz à medida que a distância
diminui.
Carlos: Isso me lembra a aula sobre a Física de
Aristóteles: ele afirmava que a potência e o ato formavam a estrutura dos
entes finitos. A potência só pode ser descrita por sua relação com o
ato, pois é a possibilidade de se transformar em
ato. Já o ato é a realidade desdobrada; juntos eles são a transformação
do ser, o devir.
Tânia: E depois você diz que a Química é que é
complicada... (ri) Mas é isto mesmo: a energia potencial é aquela que se
transforma na energia cinética, que corresponde ao seu ato. As duas
juntas formam a energia total do sistema, o seu devir...
Carlos: Então essas duas energias existem juntas?
Tânia: Sim! E a energia total de um sistema é a soma das energias cinética e
potencial.
Etotal = Ec + Ep
O valor da energia total é sempre constante, é o que os cientistas chamam de
Lei da Conservação da Energia. Isso não quer dizer que uma forma de energia
não possa se transformar em outra, e sim que a sua soma terá sempre um valor
constante para um dado sistema. Para você que gosta de futebol, um bom
exemplo é uma bola que é lançada para cima. No início do lançamento, ela tem
energia cinética alta e energia potencial nula. No início da queda ocorre o
inverso: sua energia potencial é alta e sua energia cinética é zero. Podemos
calcular o valor de cada uma das energias em todos os instantes, você vai
ver que a sua soma é constante. À medida que uma energia aumenta, a outra
necessariamente diminuirá.

Essa variação de energia pode ser expressa como o resultado do valor final
da energia menos seu valor inicial. Assim:
∆E = Efinal – Einicial
Outra situação interessante é a questão das transformações químicas, já
que geralmente elas ocorrem com
troca de energia. Neste caso, a forma mais utilizada para expressar a
energia é a Entalpia (H). Mas a expressão matemática é praticamente a mesma:

Então, se numa reação química ocorre liberação de energia para o meio
externo, a Hfinal será menor que a Hinicial, logo ∆H é
negativo (menor que zero). Esse processo é chamado de exotérmico.
Carlos: Ah, isso eu sei! Ex quer dizer para fora, como em exportação,
externo...
Tânia: Isso! Então, uma reação exotérmica coloca energia para fora. (faz uma
pausa) Continuando: por outro lado, se a transformação química requer
absorção de energia, a Efinal será maior do que a
Einicial, logo ∆E é positivo (maior que zero). Esse processo é
então chamado de endotérmico. Assim sendo:
∆H < 0 processo
exotérmico
∆H > 0
processo
endotérmico
Carlos: Energia negativa? Pensei que isso era coisa de esoterismo...
Tânia: Ih, você misturou as estações... Observe que o valor negativo de
∆H representa apenas um referencial, ou seja, a quantidade de energia final
é menor que a quantidade de energia inicial, não quer dizer que a energia
apresenta valor negativo. Além disso, é importante lembrar que a Lei da
Conservação da Energia continua valendo. A energia absorvida na
transformação química veio do meio externo, que teve sua energia diminuída.
Da mesma forma, se a transformação química ocorreu com liberação de energia,
o meio externo teve sua energia aumentada.
Carlos: E essa liberação de energia pode ocorrer na forma de calor, então!
Nossa, estou começando a entender Química! Peraí, se o calor é medido em
calorias, o que a gente mede com o termômetro?
Tânia: Medimos a temperatura, que é a medida daquela mesma energia cinética
que falamos antes, associada às moléculas presentes em um corpo.
Carlos: E por que aqui falamos
em graus Celsius e nos Estados Unidos eles falam em graus Fahrenheit?
Tânia: Existem diferentes escalas de medida de
temperatura, as mais conhecidas são: a
Celsius, a Fahrenheit, a Réaumur... Mas a unidade oficial de
temperatura é o kelvin. Sabe por quê? O valor de zero kelvin
corresponde a um estado em que a energia cinética de uma molécula ou de um
átomo seria a menor possível, quer dizer, ela estaria completamente parada,
sem vibração das suas ligações nem qualquer movimento aleatório. Um kelvin
(1 K) corresponde a 1/273,15 da temperatura do ponto triplo da água, que é
0,01 oC.
Carlos: Então o grau kelvin é medido a partir do grau Celsius? Fiquei
confuso...
Tânia: Não! Primeiro, não é grau kelvin, é só kelvin. Ele é uma unidade de
medição de temperatura, mas não é uma escala, como a escala Celsius. Na
escala Celsius, criada em 1742, foi definido que o ponto de congelamento da
água corresponderia a 0oC e o ponto de ebulição da água
corresponderia a 100oC, desde que medidos à pressão atmosférica
padrão. 1oC corresponde a 1 K. Você pode converter valores de
graus Celsius em kelvin pela fórmula
K = °C + 273,15
O grau Fahrenheit foi criado em 1724; hoje em dia é usado em poucos países,
mas entre esses países estão os Estados Unidos, o que dá muita força
econômica a ele. O ponto de congelamento da água nessa escala é
32oF; o ponto de ebulição é 212oF. Existe uma
outra escala chamada Rankine, em que o valor zero corresponde a 0
K, mas um grau Rankine (1oRa) corresponde a 1oF.
Além dessas, tem a escala Réaumur, que foi muito utilizada na França, e que
se baseava em um termômetro feito com álcool e não com mercúrio, mas essa
escala caiu em desuso. O valor de 0oRe corresponde a
0oC, mas nesta escala, o ponto de ebulição da água é
80oC.
Carlos: Essa conversa toda está me dando calor... Chega!
Vou para o quarto ligar o ar-condicionado e dormir! Até amanhã!
Tânia: Ah, mas não bota muito frio não, tá?!
{Será que poderíamos criar escalas do tipo volume de
som, interligadas, em que ajustando um valor em uma escala, obteríamos o
valor em outra? }
-------------------------------------------------------------------------------------------------------------------------------------------------------------------
Do que é feita a matéria?
Como descrever átomos se não os vemos?
Na busca pela compreensão da estrutura da matéria Tânia e Carlos discutem sobre o tema...
Conceitos desta aula: A matéria é feita por átomos
Estrutura Atômica
A formação de moléculas
A Existência de Íons
Cena 1
Personagens:
Tânia
Carlos Eduardo
Ilustrações:
1 - Vista interna do quarto de casal da casa da Tania. No quarto uma cama de casal, um armário, duas mesinhas de cabeceira com abajur e uma escrivaninha. Deve aparecer a porta do quarto. Carlos lê deitado na cama um livro de Filosofia e Tânia está sentada em uma escrivaninha mexendo em alguns papéis.
C: Amor, hoje me lembrei de você durante a aula na faculdade. O professor comentava sobre a formação do Universo e sobre matéria e as primeiras idéias dos filósofos gregos sobre sua constituição
T: Ah viu como nossas discussões sobre matéria e energia servem para alguma coisa??!!!
C: Não me lembrava mais que a primeira idéia de átomo tinha vindo deles. Os “caras” se perguntaram o que aconteceria se eles dividissem a matéria em pedaços cada vez menores. Será que haveria um ponto no qual um pedaço não teria mais as mesmas propriedades que o conjunto como um todo?
T: Hoje sabemos que não... mas a pergunta era muito pertinente para a época, até mesmo porque os gregos acreditavam que a matéria era constituída de quatro elementos – terra, água, fogo e ar – e que poderiam produzir todas as substâncias a partir da combinação destes quatro elementos. Veja Carlos que o conceito de elemento dos filósofos gregos é muito similar ao nosso atual, mas sabemos hoje que existem mais de uma centena de elementos químicos diferentes.
C: Calma aí Tânia, nós estávamos falando de átomos e você agora está falando de elementos... os dois são a mesma coisa?
T; Não são não, apesar de estarem intimamente ligados. Mas vamos com calma. Demócrito chamou a menor parte indivisível da matéria de átomo, mas não existia nenhum argumento científico e experimental para isso. Era como você mesmo disse uma idéia filosófica. A primeira comprovação convincente para que a matéria fosse constituída por átomos fora feita muitos séculos depois por John Dalton. Ele realizou uma série de experimentos medindo as massas dos elementos que se combinavam para formar compostos e assim elaborou sua hipótese atômica que tinha quatro pontos principais:
1º - todos os átomos de um dado elemento são idênticos
2º - os átomos de diferentes elementos têm massas diferentes
3º - um composto é uma combinação específica de átomos de mais de um elemento
4º - em uma reação química, átomos não são criados e nem destruídos, mas trocam de parceiros de modo a formar novas substâncias.
C: Então deixe-me ver se estou entendendo... a matéria é constituída por diferentes elementos que combinados entre si darão origem às diferentes substâncias que estão a nossa volta. E esta combinação se dá de uma forma específica, como por exemplo, H2O?
T: É exatamente isso! Dalton só não sabia como se dava esta proporção, que motivo levava dois átomos de hidrogênio e a se ligarem somente a um único átomo de oxigênio... Ele representava os átomos como esferas rígidas, como uma bola de bilhar...e hoje sabemos que existem partículas subatômicas e que o átomo é nuclear.
C: Este agora foi um salto muito grande para a minha cabeça...vai com calma pelo amor de Deus. Tudo bem, eu me lembro que existe aquela história de prótons, elétrons... é disso que você está falando??
T: É sim, mas espera aí cadê a Júlia hein??!! Vai dando uma lida nestas minhas anotações que eu vou ver por onde ela anda, está tudo calmo demais por aqui....
(nota 1 do caderno, aula 2)
Cena 2
Personagens:
Tânia
Carlos Eduardo
Ilustrações:
2 - Vista interna do quarto de Tânia
(similar à anterior). Carlos continua deitado na cama lendo, enquanto Tânia
entra pela porta com um gibi nas mãos.
T: Ela estava lendo gibi no quarto... Olha que curioso, ela estava lendo uma
história de um cientista maluco e veja o desenho que eles usam como
símbolo
do laboratório ...
C: Seria o modelo de Rutherford né?
T: Isso! E era o que eu queria te mostrar sobre partículas subatômicas, uma idéia que nem de longe existia para os gregos antigos. Hoje caracterizamos todos os átomos, e por sua vez elementos, de acordo com seu número atômico (Z). Este número representa a quantidade de prótons (p) existentes dentro do núcleo. E como um átomo é eletricamente neutro, o número de prótons é igual ao número de elétrons.
C: Mas se bem entendi os prótons são partículas de cargas positivas certo? E sendo assim não deveriam sofrer repulsão entre si dentro do núcleo?
T: Sim, caso dentro do núcleo não houvesse os nêutrons (n). Essas partículas de massa muito similar a dos prótons e sem carga, têm como função minimizar esta repulsão dentro do núcleo. Elas se encontram em igual ou superior quantidade em relação ao número de prótons. Veja que como os elétrons têm massa muito pequena, quase toda a massa de um átomo se encontra no núcleo e ela pode ser determinada pelo que chamamos de número de massa (A), dado pela soma de prótons e nêutrons. Veja esta representação aqui:
|
|
PARTÍCULA |
SÍMBOLO |
CARGA |
MASSA |
|
No núcleo |
próton |
p |
+1 |
1 |
|
neutron |
n |
0 |
1 |
|
|
Na eletrosfera |
elétron |
e- |
-1 |
1/1836 |
C: Mas representamos os átomos e elementos, que eu ainda não entendi bem a diferença, por símbolos...
T: Eu chego lá Carlos, tenha paciência estamos perto. Exatamente, representamos por uma letra maiúscula que remete ao seu nome. Alguns por uma letra maiúscula seguida de uma minúscula. Isso causa uma enorme confusão na cabeça de meus alunos. Quando o símbolo não remete ao nome em português.
C: Disso eu me lembro, a grande maioria dos elementos têm seu nome derivado do
latim e assim enxofre tem símbolo S (do latim Sulfur), sódio tem símbolo Na
(do latim Natrium), potássio tem símbolo K (do latim Kalium), etc...
T: Isso mesmo e você não tem idéia do quanto de confusão isto gera... Então
Carlos, já temos todas as ferramentas para que você saiba do que a matéria é
feita. É feita de átomos que representamos por símbolos e que têm números
característicos que os evidenciam. Assim representamos desta forma aqui:
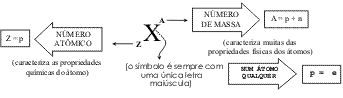
T: E antes que você me pergunte novamente me deixe continuar para te explicar de uma vez por todas a diferença de átomo para elemento. O que você precisa lembrar Carlos é que existe um fenômeno chamado isotopia ...
C: Iso quem??
T: Isotopia é um fenômeno pelo qual dois átomos apresentam o mesmo número atômico mas diferentes números de massa. No fundo eles são “iguais” pois apresentam as mesmas propriedades químicas, contudo têm número de nêutrons diferente dentro do seu núcleo. Quase todos os elementos apresentam isótopos. E eles são muito importantes no nosso dia-a-dia. Você não lembra do acidente de Goiânia com césio-137 (137Cs) , ou o enriquecimento de urânio ou ainda a datação por carbono-14 (14C)? Então são exemplos de isótopos importantes.
C: Na realidade quando falamos de césio-137 estamos falando de apenas um isótopo? Acho que estou entendendo agora. Na realidade um elemento químico representa um conjunto de todos estes isótopos ao mesmo tempo...
T: Elementar meu caro Carlos. Quando falamos de um elemento estamos falando de todos os isótopos, até mesmo porque é muito difícil de separá-los. É importante que você saiba também que existe um percentual de ocorrência de cada um deles na natureza. É o que chamamos de ocorrência ou abundância isotópica. Desta forma um elemento químico possui número atômico (igual para todos os isótopos) mas não apresenta número de massa e sim o que chamamos de massa atômica...
C: Vai devagar...
T: A grosso modo podemos chamar o elemento de um “átomo médio”. Uma média entre todos os seus isótopos. Assim a massa atômica nada mais é do que uma média dos números de massa dos átomos isótopos. Só que esta média tem que ser ponderada (popup para um exemplo de cálculo) uma vez que as ocorrências isotópicas não necessariamente são iguais para todos os isótopos de um elemento.
C: Matemática é comigo mesmo....
----
exemplo pop up
Isótopos do Cloro: 17Cl35 (75%) e 17Cl37 (25%)
MACl = (35 . 75) + (37 . 25) = 35,5 u.m.a
100
Cena 3
Personagens:
Tânia
Carlos Eduardo
Julia
Ilustrações:
1 - Vista interna do quarto de Tânia (similar à anterior). Carlos continua deitado na cama. Nesta ilustração Tânia está sentada ao lado de Carlos na cama, como se conversassem. Julia entra pela porta carregando materiais escolares (livro, caderno, lápis...)
J: Papai você pode me ajudar com o dever de casa?
C: Claro minha filha, qual é o assunto?
J: A professora pediu que fizéssemos uma pesquisa sobre a importância de uma boa alimentação para a manutenção da saúde...Por que devemos ingerir leite, feijão, carne, etc...
C: Essa é fácil minha filha.... esses alimentos são ricos em cálcio, ferro, etc.. Elementos essenciais ao bom funcionamento do organismo.
T: Pois é Carlos mas por que será que obtemos ferro do feijão e não chupamos um prego? Os dois não têm ferro? Minha filha, nestes alimentos existem compostos a base de cálcio e de ferro. Este ferro Carlos, não é o mesmo ferro que está no prego. Tanto ele quanto o cálcio do leite se encontram na sua forma iônica!
C: Julinha lá vem ela de novo....
T: Mas Carlos isso é fundamental para o que estávamos discutindo e para a formação da matéria. Lembra que vimos que o átomo é eletricamente neutro (número de prótons igual ao número de elétrons)? Então ao formar novos compostos os elementos podem perder ou ganhar elétrons (e até mesmo compartilhá-los) de modo que esta igualdade deixa de existir. O átomo pode não ser eletricamente neutro, e aí chamamos de íon.
C: Se eu estou entendendo, caso ele perca elétrons, o número de prótons será maior que o de elétrons e aí teremos um íon positivo. Caso contrário, ao ganhar elétrons, o número de prótons será menor e teremos um íon negativo.
T: Brilhante meu amor!! O íon positivo é chamado de cátion e o negativo chamado de ânion. Veja este esquema, ele resume tudo.
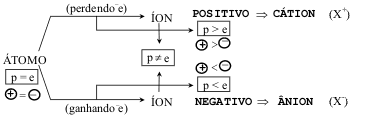
C: Vamos devagar...posso dizer então que a carga do íon será dada pela quantidade de elétrons ganhos ou perdidos por este elemento?
T: Perfeito Carlos, você já praticamente um químico!! Brincadeiras a parte é isso mesmo, a carga do cátion, e do ânion, sempre será dada por esta quantidade de elétrons trocados. Chamamos, ainda, esta carga de valência. Assim se dizemos que um dado elemento forma um cátion bivalente, estamos querendo dizer que ele perde dois elétrons, logo terá uma carga +2.
C: Isso é muito confuso, só na Química mesmo que quando alguém perde alguma coisa fica positivo, como se estivesse ganhando...
T: Você está parecendo um de meus alunos...Carlos preste atenção, pois o sinal indica a carga elétrica gerada. Ter uma carga +2 significa apenas que aquele elemento tem dois prótons a mais que elétrons. Lembra que conversamos que o átomo era neutro? Então ao perder dois elétrons, terá duas cargas positivas a mais. Entendeu?
C: Acho que sim!!
J: Pois eu estou viajando, o que essa história toda tem haver com o meu dever de casa? Podemos voltar a minha lição?
T: Claro que sim minha filha. Nosso organismo é feito de uma pequena quantidade de elementos químicos diferentes. Um pouco de carbono, um punhado de hidrogênios, alguns oxigênios, uma meia dúzia de metais... E precisamos repor algumas quantidades destes elementos para que nosso organismo funcione de maneira correta. Estes elementos vêm, na sua maioria, de nossa alimentação.
J: Acho que estou entendendo, mas a gente e feito só dessas coisas aí que você falou? A nossa volta parecem ter coisas tão diferentes umas das outras?
T: É verdade meu amor, as coisas são muito diferentes mesmo umas das outras. Este é o fascinante mundo da Química. Vou dar um exemplo bem prático...Na folha de uma árvore tem carbono, na madeira que faz a cadeira da sala também, nesta folha de papel que você está escrevendo também, assim como no grafite do seu lápis, nos fios de seu cabelo, neste seu brinco de plástico, na sua pele... Ta vendo filha um mesmo elemento químico pode aparecer em diferentes formas. É o que os químicos chamam de compostos químicos.
C: Acho que estamos voltando àquele assunto sobre matéria e sobre os postulados de Dalton.
T: Claro que sim, nunca deixamos o nosso tema central de lado. Compostos químicos são substâncias eletricamente neutras que consistem de dois os mais elementos químicos ligados entre si dentro de uma proporção definida, assim como disse nosso bom John Dalton. Estes compostos ainda sofrem uma classificação muito importante. Podem ser chamados de compostos orgânicos ou inorgânicos. Os orgânicos são uma classe de compostos onde todos possuem carbono em sua estrutura e geralmente hidrogênio também, além de alguns outros elementos. São exemplos de compostos orgânicos, os combustíveis, todas as vitaminas que ingerimos na alimentação, açúcares, medicamentos, etc. Foram assim chamados, pois acreditava-se que só podiam ser obtidos a partir de organismos vivos (Teoria da Força Vital). Mas este conceito é errado, uma vez que já é sabido que podemos obter uréia, por exemplo, a partir de compostos inorgânicos. Os inorgânicos formam todo o resto dos compostos, como água, amônia, os gases poluentes da atmosfera, os óxidos, etc. Dentro dos inorgânicos podemos ter compostos simples de carbono, como o monóxido e o dióxido de carbono e os carbonatos.
C: Enquanto você estava falando eu me lembrava que a minha professora de Química, nos fez decorar que o sal de cozinha era um composto iônico e que a água era um composto molecular...nossa isso faz muito tempo....
T: É uma boa hora para recordarmos isso também. Os compostos iônicos são formados como o próprio nome diz por íons que nós já sabemos o que é. Desta forma um átomo perde elétrons (formando um cátion) e outro ganha elétrons (formando um ânion). O sal de cozinha é um bom exemplo. O sódio (Na) perde um elétron para que o cloro (Cℓ) ganhe um elétron. Uma boa forma de imaginarmos um composto iônico é colocarmos um número enorme de cátions e ânions num arranjo regular (popup para cristal de NaCℓ).
C: Pode acontecer o caso de a quantidade de elétrons que um deseja perder seja diferente da quantidade que o outro deseja ganhar?
T: Claro que sim. Quando a “vontade” de um é diferente da do outro, o que mudará é a proporção entre eles (popup para exemplos). Não podemos perder de vista que o composto deve ser eletricamente neutro. Você deve estar se perguntando como saber a “vontade” de cada um. Mas vamos deixar isso para uma outra hora.
C: Tudo bem, eu já estou ficando com fome mesmo. Mas pelo menos termina falando sobre os compostos moleculares...
T: Os compostos moleculares são aqueles formados por ligação covalente, onde ocorre compartilhamento de elétrons. Geralmente chamamos sua fórmula química de fórmula molecular. Ela representa a proporção entre os elementos químicos ligados naquele composto. Assim a água é H2O, a sacarose C12H22O11 e assim por diante. Mas para que você entenda melhor sobre isso precisamos conversar um pouco sobre ligações químicas.
J: Ah!! Agora não que minha barriga está roncando. Podemos comer pelo amor de Deus!!
C: Eu concordo com a Julinha meu amor, vamos deixar essa história de ligação para depois pois meu cérebro já desligou depois de tantos átomos, moléculas e íons.
--------------------------------------------------------------------------------------------------------------------------------------------------------------------
Todo sistema heterogêneo é uma mistura heterogênea?
A partir da confecção de um simples bolo, e da vida cotidiana, a família Mol se vê diante de várias situações onde as substâncias se misturam...
Conceitos desta aula: Substâncias Puras e suas Classificações
Misturas e suas Classificações
Propriedades da Matéria
Gráficos de Mudança de Estado Físico
Cena 1
Personagens:
Tânia
Júlia
Ilustrações:
1 - Na cozinha de sua casa, Tânia
e Júlia preparam um bolo para depois do jantar. Tânia segura uma mexe com
uma colher de pau uma vasilha. Júlia segura um pacote de farinha nas
mãos
J: Oba mãe, eu adoro bolo de chocolate!
T: Eu sei minha filha que você adora, mas anda abusando um pouco da quantidade de doce. Será este bolo e depois chega de doce...Ande, me ajude passando estes ingredientes para que eu possa terminar essa mistura.
J: Eu aprendi na Escola estes dias, que quando juntamos coisas diferentes formamos uma mistura. E que se elas estiverem sozinhas são puras. Podemos fazer uma mistura de água com sal e de água com areia, por exemplo.
T: Você anda muito sabida hein Julia??!! Agora quero ver se sabe mesmo, qual é a diferença entre estas duas misturas, a água e sal e a de água e areia?
J: Isso é muito fácil, o sal dissolve na água e a areia não...
Cena 2
Personagens:
Tânia
Júlia
Carlos
Ilustrações:
1 - Ilustração similar à anterior. Tânia e Julia preparam um bolo na cozinha. Carlos entra pela porta, com a cara e as mãos sujas (a roupa pode estar suja também), carregando um pote na mão
T: O que foi isso meu amor, veio da guerra?
C: Vai brincando bem Tânia, deu sorte que o carro enguiçou na minha mão. Vazou óleo do motor para a água do radiador e o carro superaqueceu. Mas já concertei.
T: Que horror, ainda bem mesmo que foi com você! Olha aí Julinha, mais uma mistura interessante na mão do papai!!
C: Que papo é esse de mistura?
T: Meu amor vai tomar um banho e depois a gente conversa sobre isso. Vai depressa que já está quase tudo pronto.
C: Deixa eu sentar um pouco, já vou já.
J: O óleo também não dissolve na água né mãe?
T: Isso mesmo meu amor, não dissolve. Quando temos misturas com mais de um aspecto, a chamamos de heterogênea. É o caso de água e areia, água e óleo. Quando ela possui um único aspecto chamamos de homogênea. Cada um destes aspectos é chamado de uma fase.
C: É verdade eu lembro disso...Quando possui duas fases é chamada de bifásica, três fases trifásica e assim por diante. Mas como diferenciar uma mistura de água com sal e um copo de água pura? Os dois têm a mesma cara...acho que só provando mesmo...
T: Claro que não Carlos. A água pura tem propriedades específicas diferentes da mistura. Estas propriedades são ponto de fusão e ebulição, densidade e solubilidade.
J: A professora falou isso para a gente também. Ela também disse que a água fica na parte debaixo pois tem a densidade maior que a do óleo.
T: Isso aí minha filha!! Uma mistura de água com sal, por exemplo, terá uma densidade maior do que a água pura. Mas concordo com você Carlos que isso gera certa confusão. Por exemplo, nem todo sistema homogêneo é uma mistura homogênea, ele pode ser uma susbstância pura. Assim como nem todo sistema heterogêneo é uma mistura heterogênea, pode ser uma substância pura em diferentes estados físicos. É o caso de um copo com água e cubos de gelo. Tem duas fases (a água líquida e os cubos de gelo), mas ambos são formados pela mesma substância.
C: Mas como eu vou saber que a densidade da água com sal é maior e não menor?
T: Ora Carlos esqueceu tudo o que aprendeu na Escola. A densidade é uma grandeza que expressa a razão entre a massa de um corpo e o volume que este corpo ocupa. Desta forma, vamos admitir que tenhamos colocado 5g de sal em um copo de 500 mL de água. Vamos admitir ainda que esta massa de sal não tenha alterado de forma significativa o volume final. Refaça agora as contas!! O volume é o mesmo, mas a massa aumentou e, conseqüentemente, a densidade aumento também.
C: Pensando assim realmente... É que esta sua Química tem muitos nomes e definições. Sempre me confundi com alguns destes termos. Nunca entendi bem aquela história de substância simples e composta. Para mim substância simples é a pura e a composta, já que é composta, é uma mistura...
T: Veja Carlos, não é bem assim... substâncias simples e compostas são diferentes de misturas. Substâncias simples são aquelas formadas por um, único tipo de elemento químico, como por exemplo O2, N2, Cℓ2, etc. Já as substâncias compostas são aquelas formadas por pelo menos dois elementos químicos diferentes, como por exemplo o sal de cozinha (NaCℓ), a água (H2O), o ácido nítrico (HNO3), etc. Ambas podem ser puras, desde que no frasco que as contém só haja uma único tipo de molécula.
C: Acho que estou entendendo. Mas mesmo sendo simples ou compostas apresentam os mesmos tipos de propriedades.
T: Claro que sim!! As substâncias puras possuem propriedades químicas e físicas constantes. Assim a água pura (pura mesmo), ao nível do mar, possui ponto de ebulição 100ºC e ponto de fusão 0ºC, e densidade aproximada de 1,0 g/cm3. Já as misturas, por possuírem composição variada, apresentam propriedades que variam também. Assim se colocarmos uma pequena quantidade de sal na água sua densidade será pouco maior do que 1,0 g/cm3. Já se colocarmos uma quantidade maior, a densidade será ainda maior. Depois que você tomar banho vou te dar umas anotações minhas para que você entenda melhor...
C: Acho melhor eu ir depressa para o banho...
{ nota 1 da aula 3}
Caderno
-------------------------------------------------------------------------------------------------------------------------------------------------------------------
Profa Tânia Cristina: Professora de Ciências do Colégio Vicente Telles
Carlos Eduardo: marido da Profa Tânia
Júlia: filha de Tânia e Carlos, de 7 anos
Cena 1: Carlos Eduardo sentado em frente ao computador, lendo uma matéria
do Portal da Educação Pública: "Contando estrelas". Ele deve estar com a
filha próxima e com um copo transparente contendo dois dedos de água.
C: Veja que reportagem interessante filha, cientistas da Austrália encontraram um valor aproximado para o número de estrelas no céu.
J: Nossa! E quantas são?
C: Advinhe?!!..
J: Huuummm, deixe-me pensar... Acho que tem umas dez estrelas, pelo menos aqui em casa. Lá na casa da vovó, deve ter mais de cem. O céu lá é cheio de estrelas!
C: rssss... É mesmo querida, o brilho das lâmpadas das cidades grandes ofuscam o céu, por isso lá da casa da vovó, que mora mais para o interior, o céu parece mais estrelado que o nosso.
J: Mas não tem mais estrelas lá?!
C: Tem não filha, o céu de lá tem tantas estrelas quanto o nosso. O que
atrapalha é que seja na casa da vovó ou aqui não somos capazes de contar tudo.
Não vemos as coisas como elas são, nós a vemos como nós somos.
J: Mas você não disse quantas estrelas no céu existem afinal?!
C: Aqui está escrito sete vezes dez elevado a vinte e dois (7. 1022 )
J: hein?!!
C: É mesmo um valor surpreendente filha. Vamos fazer um conta simples na minha
máquina, se eu demorasse 1 segunda para contar cada estrela, demoraria
Cena 2: Tânia apontando para o copo d´água, meio com ar de deboche,
com a filha e o pai observando ela.
C: Xiiii, filha... acho que desta vez a mamãe andou bebendo muita água por ai... rsss
J: Mamãe, você está falando sério?!
T: Claro que estou filha. Não foi o seu pai que te disse "precisamos aprender
a perceber o quanto somos capazes de enxergar"? Ele está certíssimo. Tanto faz
se olhamos para o céu ou para aqui, na Terra, usualmente não estamos
acostumados a perceber o quanto este universo é grande.
C:
T: É inconveniente para os químicos lidar com número tão grandes, por isso
convencionamos utilizar um unidade representativida, chamamos de mol. O mol é
como se fosse a duzia para o feirante
dia do mol -->23 de outubro
{{{Inserir figura do ceu com estrelas e o copo d´água. Pergunta: Você sabe quantas estrelas caberiam em dois dedos de um copo d´água?}}
Ou seja, se cada estrela fosse equivalente a uma molécula de água, seriam necessários cerca de 8 universos inteiros e mais um meio (i.e.6,02.1023/ 7.1022) para conter nosso copo.
Com os olhos químicos, faz mais sentido uma das mais conhecidas poesias do William Blake {{link}}:
“Ver o Universo no grão de areia
e o Paraíso em uma flor;
segurar o Infinito na palma de sua mão
e notar a Eternidade em uma hora.”
· Uma simples gota d´água contem 2 sextilhões de átomos de oxigênio (2 x 1021 ou 2 seguidos de 21 zeros) e o dobro de hidrogênios.
· Uma partícula de poeira contem cerca de 3 trilhões (ou 3 x 1021) átomos.
· Uma típica célula humana contem aproximadamente 100 trilhões de átomos. O vírus da AIDS tem 800 átomos de carbono de espessura e contem aproximadamente 100 milhões de átomos ao todo.
· O número de átomos em 12 gramas de carvão (i.e., aproximadamente 6 x 1023) é mais do que 1.400.000 vezes maior que a idade do universo em segundos.
· 18 ml de H2O (ou 6 x 1023) ocupa uma altura próxima de um dedo em um copo comum de plástico (300 ml). Mas será pouco mesmo?
Acredita-se que o número total de elétrons que caberiam no universo conhecido é da ordem de 10130 ou 100000000000000000....
Atividade
Um grão de tem cerca de 2 mg (microgramas). Considerando que este grão é formado somente por óxido de silício (SiO2), calcule a quantidade de átomos de oxigênio (O) neste grão.
Simply put, the mole represents a number. Just as the term dozen refers to the number twelve, the mole represents the number 6.02 x 1023. (If you're confused by the form of this number refer to the Scientific Notation lesson).
Now that's a big number! While a dozen eggs will make a nice omelet, a mole of eggs will fill all of the oceans on earth more than 30 million times over. Think about it: It would take 10 billion chickens laying 10 eggs per day more than 10 billion years to lay a mole of eggs. So why would we ever use such a big number? Certainly the local donut store is not going to "supersize" your dozen by giving you a mole of jelly-filled treats.
The mole is used when we're talking about numbers of atoms and molecules. Atoms and molecules are very tiny things. A drop of water the size of the period at the end of this sentence would contain 10 trillion water molecules. Instead of talking about trillions and quadrillions of molecules (and more), it's much simpler to use the mole.
History of the Mole
The number of objects in one mole, that is, 6.02 x
1023, is commonly referred to as Avogadro's number. Amadeo Avogadro
was an Italian physics professor who proposed in 1811 that equal volumes of
different gases at the same temperature contain equal numbers of
molecules. About fifty years later, an Italian scientist
named Stanislao Cannizzaro used Avogadro's hypothesis to develop a set of
atomic weights for the known elements by
comparing the masses of equal volumes of gas. Building on this work, an
Austrian high school teacher named Josef Loschmidt calculated the size of a
molecule of air in 1865, and thus developed an estimate for
the number of molecules in a given volume of air. While
these early estimates have since been refined, they led to the concept of the
mole - that is, the theory that in a defined
mass of an element (its
atomic weight) there is a precise number of atoms:
Avogadro's number.
Carlos Eduardo: marido da profa. Tânia;
Júlia: filha de Tânia e Carlos, de 7 anos.
Mariana: amiga e vizinha de Júlia, também de 7 anos.
Por que a água do mar é salgada e a água do rio é doce? Será que numa tem sal e na outra açúcar?
Procurando esclarecer estas e outras questões, a professora Tânia ajuda as pequenas Júlia e Mariana a desevendar o universo microscópico que compõe as soluções.
-------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
CENA 1 (Casa da Tânia - sala de estar)
Personagens:
Tânia
Carlos Eduardo
Júlia
Mariana
Ilustrações:
1. Sala de estar da casa da Tânia. Tânia, Carlos, Júlia e sua amiguinha Mariana se preparam para ir à praia. O dia está ensolarado, como pode ser visto pela janela da sala, e as meninas estão sorridentes. Tânia está com sua bolsa de praia e Carlos possui um livro que vai levar pra ler na praia. As meninas escolhem seus brinquedos para levar no chão da sala. Carlos está sentado no sofá e Tânia, em pé, pede para as meninas se apressarem.
Numa manhã ensolarada de domingo, Tânia, Carlos, Júlia e sua amiguinha Mariana se preparam para uma prazerosa manhã na praia. Tânia não sabe, mas a sua manhã será de muito trabalho!
T: Vamos logo com essas escolhas, meninas! Não é bom chegar na praia muito tarde...
C: Taí uma questão que eu tenho vontade de aprender. Que diferença faz eu ir à praia agora, às 7 h da manhã em pleno domingo, ou ir ao meio-dia? Meu amor, hoje é domingo, será que não dava pra acordar um pouquinho mais tarde?
T: Deixa de ser preguiçoso! No caminho eu lhe explico porque faz mal à saúde tomar banho de sol após um certo horário.
C: Meninas: tudo pronto?! Então vão indo pro carro que eu vou pegar a caixa de isopor com água e refrigerante.
T: Muito bem! Com esse calor temos que nos hidratar bastante e ingeir sais minerais.
C(rindo): Eu falei que eu ia pegar água e refrigerante, não falei em sal de cozinha!
T(rindo): Xiiii... Já vi que o nosso caminho até a praia vai ser longo!
------------------------------
CENA 2 (Dentro do carro)
Personagens:
Tânia
Carlos Eduardo
Júlia
Mariana
Ilustrações:
1. Visão de dentro do carro. Tânia (carona) e Carlos conversam com pequenas interrupções das meninas. De dentro do carro se escutam sons de buzina em virtude do engarrafamento à caminho da praia.
C: Eu não acedito que vamos ter que encarar este engarrafamento logo tão cedo. Acho que vamos chegar na mesmo hora que chegaríamos se tivéssemos saído mais tarde de casa. Você falou que o caminho ia ser longo, acabou que vai ser mesmo!
T: Deixa de ser exagerado! Daqui a pouco estamos chegando.
J: Mãe, você trouxe o protetor? Não quero ficar parecendo um camarãozinho depois...
M: Mas a gente já passou protetor em casa, antes de sair...
T: É claro que eu trouxe. Mesmo já tendo passado o protetor, vocês precisam passar novamente depois de um certo período de exposição à radiação ultravioleta, emitida pelo Sol.
C: Já que você falou em radiação do Sol, me explica por que não poderíamos ter saído mais tarde de casa?
T:
-------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
-------------------------------------------------------------------------------------------------------------------------------------------------------------------
APRESENTAÇÃO:
1 - Close personagens:
- Ana Maria - Diretora do Colégio
- Tânia Cristina - Professora
- Carlos Eduardo: marido
- Júlia - filha
Ilustrações CENA 1 -Aula 1:
1 - Vista externa da escola
2 - Sala da diretora, quadro de avisos ao fundo, mesa de escritório, porta entreaberta, Tania em pé e diretora sentada em sua mesa conversam
Ilustrações CENA 2:
1 - Vista interna cozinha casa Tania. Tania cozinhando, Julia próxima chupa um picolé junto ao fogão e Carlos está em pé ao fundo
2 - Close panela fumegando diante do rosto de Julia
Ilustrações CENA 3/4:
1 - Vista interna sala de estar casa Tania. Carlos lê livro no sofá. Tania
está na mesa, com pastas e papéis, voltada para Carlos, com quem conversa.
--------------------------------