distribuição de tarefas.
- Matéria e Energia --> Joaquim
- Átomos Moléculas e Íons --> Mauro
- Soluções e Concentração --> Rodrigo
- Reações Químicas
---------------------------------------------------------------------------------------------------------
Era uma vez...
cinco professores, todos de Química. Estavam sentados em
sua pequena sala e refletiam sobre um problema que os preocupava: tinham como
missão ensinar outros professores, esmeravam-se por isso, mas, por estranhos
desígnios do destino tinham um desafio adicional: dificilmente teriam ocasião de
ver seus alunos. De certa forma eram invisíveis para eles. Decerto cada
qual tinha o sentimento da presença; por vezes trocavam mensagens, alguns com
maior freqüência; mas não poderiam ver-lhes os olhos, trocar um gesto ou um
sorriso com eles; ficava apenas uma sensação inefável, porém distante. Como
transmitir-lhes algo além das palavras? Como sustentar-lhes o interesse por
atualizar-se em um estudo de Química, superando os textos insossos,
propondo-lhes desafios que se somariam aos seus pessoais, como os de sua própria
profissão de ensinar? Para agravar, eles sabiam que muitos dos alunos do curso
são professores de Química não tinham se formado nessa área. Que ações tomar?
Que caminhos percorrer?
De repente, uma mensagem chegou a todos, como um e-mail a
vários destinatários:
- Comecemos então do zero!
Essa situação descreve poeticamente a criação do curso Química Zero. Por diversas vezes, nós, da equipe de Química da Fundação CECIERJ, recebemos como demanda a preparação de materiais didáticos especialmente preparados para professores que tiveram formação insuficiente em Química ou que fizeram licenciatura em outra área. Para dar a você uma dimensão dessa demanda: quase 50% dos professores que acessam nossos cursos fizeram faculdade em outra área. São principalmente biólogos; mas há vários matemáticos, pedagogos, engenheiros etc. Alguns ainda estão terminando a licenciatura, mas por algum motivo vêm-se obrigados a lecionar Química. É para esses profissionais que direcionamos o curso.
Alguns temas parecem preocupar mais que outros. Freqüentemente, para esses alunos, o grande vilão tem sido cálculo estequiométrico, seguido por alguns assuntos relacionados, como balanceamento de reações, concentração e cálculos de rendimento. Neste curso pretendemos dar as bases para a compreensão desses conceitos, que serão aprofundados na próxima série deste curso.
O curso Química Zero nasce com alguns compromissos
claros. O primeiro deles é realmente começar do zero, ainda que nós
saibamos que algumas vezes você poderá dizer: "ah, isso eu já sei
suficientemente bem" (mas esperamos supreender você nesses assuntos
também!).
O segundo compromisso é apresentar e estudar esses temas de
forma inovadora e cativante, para ampliar suas possibilidades
pedagógicas.
Para isso, à semelhança do "Era uma vez..." que você leu,
estamos usando a linguagem do conto (veja a aba Aulas), contando a
história da simpática família Mol e seus amigos (você lerá a
seguir).
Além de seu aspecto lúdico, os contos contêm diversas
analogias, informações contextualizadas. E mais: no Caderno de notas
estão alguns aspectos teóricos mais importantes.
É bom que você saiba que esta é uma proposta nova para nós também, e, sendo assim, estamos abertos a críticas e sugestões construtivas.
As atividades a distância (ADs) constam como abas à parte (Atividades), e podem ser consultadas a qualquer momento do curso. As respostas devem ser enviadas para o endereço eletrônico tutorquimica@yahoo.com.br, assim como eventuais dúvidas ou comentários sobre o curso. Por delicadeza, lembre-se de colocar no campo Assunto (ou Subject) do e-mail o nome do curso e o número da atividade (ex.: Química Zero - Atividade 4).
A responsabilidade pelo curso neste trimestre (2008.1) é o
professor Mauro Braga. Ele está responsável não somente por receber e corrigir
as atividades, mas por solucionar dúvidas ou sugerir novas formas de entender e
ajudar você a resolver algum problema. Eventualmente, você pode trocar uma
história ou, quem sabe, uma piada de Química com ele. É gente
boníssima!
O conteúdo do curso Química Zero foi distribuído em sete
temas, conforme o quadro abaixo. Lembre-se de que você poderá acessá-los a
qualquer momento no Índice Geral, em qualquer ordem.
Aula 1 - Matéria e energia
{{linkar com a aula 1}}
Aula 2 - Átomos, moléculas e íons {{linkar com a aula 2}}
Aula 3 - Substâncias simples e compostas e misturas {{linkar todos com a aula correspondente...}}
Aula 4 - Mol e massa molecular
Aula 5 - Soluções e unidades de concentração
Aula 6 - Reações químicas
Aula 7 - Estequiometria
Desde há muito tempo a humanidade conta, ouve, lê e escreve histórias, como os contos. Encantamo-nos com elas e povoamos nosso imaginário com seus personagens.
Para nos ajudar a orientar este curso, criamos um enredo com
personagens baseados em nossa experiência profissional e na vida pessoal. Para
isso, pedimos a presença da família Mol:
Tânia Cristina Mol: professora de Ciências do Colégio Vicente Telles, formada em Química e excelente cozinheira. Carinhosa, adorada pelos alunos apesar de seu rigor técnico em sala de aula e na vida.
Carlos Eduardo Mol: É matemático,
marido da profa. Tânia, amante de Filosofia e dos papos de
boteco.
Contamos também com a prestigiosa participação de Ana Maria, diretora do Colégio Vicente Telles. É professora de Ciências, mas afastada das salas de aula há algum tempo devido ao cargo que ocupa faz mais de dez anos.
------------------------------------------------------------------------------------------------------------------------
{{Rogério/Leo/Mônica, O que está abaixo pertence a Aba Atividades.}}
NOTA 1
A temperatura de um gás é uma medida da energia cinética
média dos átomos ou moléculas constituintes. Na animação está representado dois
gases ideais em solução gasosa, com uma velocidade cerca de dois trilhões de
vezes inferior ao real.

Autor da Imagem A.Greg, disponível em http://en.wikipedia.org/wiki/Image:Translational_motion.gif
NOTA 2
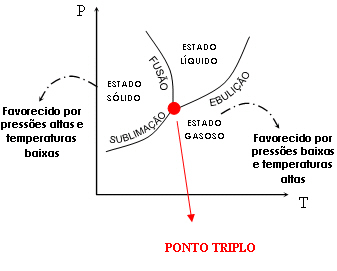
Cada substância apresenta um diagrama de fases, mas todos têm o mesmo aspecto. Nele, cada linha representa determinadas condições de temperatura e pressão externa nas quais duas fases coexistem em equilíbrio. As áreas delimitadas por cada linha representam as condições de temperatura e pressão nas quais uma substância existe em um único estado físico.
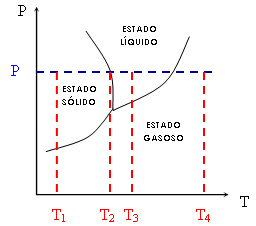
Veja que, para uma mesma pressão P constante (linha azul pontilhada) e variando a temperatura (T1-T4), passamos do estado sólido ao liquido e, finalmente, ao gasoso (T1 < T2 < T3 < T4). Note ainda que T2 representa a temperatura de equilíbrio entre o estado líquido e o estado sólido à pressão P. T2 é, então, a temperatura de fusão. O mesmo ocorreria para o ponto que representa a passagem do estado líquido ao estado gasoso, chamada temperatura de ebulição.
Observe agora este outro gráfico:
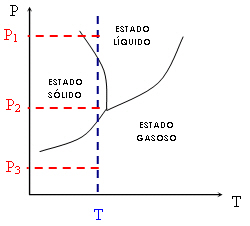
Da mesma forma, você vê que, para uma mesma temperatura T constante (linha azul pontilhada), podemos obter diferentes estados físicos variando apenas a pressão. Observando a figura abaixo, você percebe que, à temperatura constante, o estado gasoso será sempre favorecido por pressões mais baixas, enquanto os estados sólidos e líquidos são favorecidos por pressões mais altas (P1 > P2 > P3).
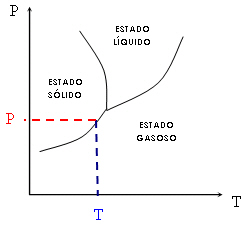
Através do diagrama de fases podemos entender o motivo pelo
qual alguns sólidos sublimam (é o caso, por exemplo, da naftalina e do
iodo). Esses sólidos possuem equilíbrio de fases sólido-gás próximo da
temperatura e da pressão ambientes. Assim sendo, passam direto do estado
sólido ao estado gasoso. Veja o gráfico seguinte:
-------------------------------------------------------------------------------------------------------------------
Estudo dos Gases:
http://br.geocities.com/galileon/2/gases/gases.htm
Web Livro: Física nas Escolas secundárias
http://www4.prossiga.br/Lopes/prodcien/fisicanaescola/indice.htm
http://www.feiradeciencias.com.br/sala21/21_12_01.asp
Videos:
Experiências "barulhentas" com gases. Em inglês
http://www.youtube.com/watch?v=cTVirpTORb0 )
GERAL
QMCWeb - Revista Eletrônica de Química da UFSC
http://www.qmc.ufsc.br/qmcweb/arquivo.htmlVestibucast:
Trata-se de um
serviço de provimento de conteúdos digitais em áudio, para vestibulandos, do
jornal Folha de S.Paulo.
O link para Química as aulas de Química
é:
Os textos estão disponíveis em:
http://www.quimica.net/emiliano/vestibular.html
--------------------------------------------------------------------------------------------------
Os experimentos eletroquímicos de Michael Faraday, em torno de 1830, foram designados para desvendar a relação entre química e eletricidade e ele afirmou a identificação das forças de afinidade química e eletricidade. Ele chamou atenção para a interconversão dos poderes de calor, eletricidade e afinidade química como um resultado de sua unidade essencial.
Faraday, a partir de 1835, havia observado descargas elétricas luminosas em tubos de vidro contendo gases. De acordo com Faraday "a rarefação do ar favorece extremamente fenômenos de incandescência". Ele observou a incandescência em diversos gases à baixa pressão.
William Crookes realizou experimentos em ampolas com gases rarefeitos...
|
Os raios catódicos moviam um pequeno catavento colocado no interior da âmpola, portanto tinham massa. |
Os raios catódicos projetavam na parede oposta da ampola a sombra de qualquer anteparo que fosse colocado em sua trajetória. Caminham, portanto, em linha reta. |
Ao ser aplicado um campo elétrico externo à ampola, os raios catódicos se desviavam para a placa positiva. Possuem, portanto, carga negativa. |
Estas experiências podiam ser observadas com qualquer tipo de gás e, portanto, eram partículas constituintes de toda espécie de matéria, passando a serem chamados de elétrons.
Continuando os estudos com ampolas de gases rarefeitos, Goldstein resolveu usar um catodo furado, pois achava que partículas positivas de massa maior que a do elétron não eram observadas pois não conseguiam atravessar o metal. Descobriu os raios canais, cuja massa variava com a massa do gás usado e que eram desviados pela placa negativa de um campo elétrico. Como o hidrogênio produzia os raios canais de menor massa, esta parte elementar do átomo foi chamada de próton.
O modelo atômico de Thomson consistia de elétrons mantidos em posição de equilíbrio por um fluido positivo e foi anunciado pela primeira vez no seu artigo de 1897.
Foi a descoberta e o estudo da radioatividade que permitiram que Rutherford idealizasse um experimento para “observar” o comportamento atômico. Até 1907, Rutherford não estava particularmente interessado em modelos atômicos. Ele era geralmente a favor da teoria de J. J Thomson, que achava útil para compreender o fenômeno radioativo. Só em 1910, ele se voltou seriamente para a teoria atômica, primeiramente como resultado do seu profundo interesse no comportamento e natureza das partículas alfa.
Rutherford fez então um feixe de partículas alfa atravessarem uma lâmina delgada de ouro, como mostrado no esquema abaixo:
A partir das observações desta experiência, Rutherford chegou a algumas conclusões:
|
OBSERVAÇÕES |
CONCLUSÕES |
|
1) A maioria das partículas atravessou a lâmina sem sofrer desvio considerável de trajetória. |
1) No átomo havia grandes espaços vazios por onde passaram as partículas a |
|
2) Algumas poucas partículas a foram rebatidos na direção contrário ao choque. |
2) No centro do átomo existe um núcleo pequeno e denso que concentra quase toda sua massa. |
|
3) Algumas poucas partículas a sofreram grande desvio de sua trajetória inicial. |
3) O núcleo do átomo tem carga positiva, pois causava grande desvio nas partículas a que passaram perto dele. |
“O átomo apresenta duas regiões distintas: um pequeno núcleo denso
envolto por elétrons que giram em torno.”
No entanto o modelo de Rutherford contrariava a Física Clássica sob dois aspectos:
1) Como um número positivo não atrairia os elétrons da eletrosfera?
2) Cargas elétricas em movimento emitem radiação eletromagnética e perdem energia. Como isto não ocorria com os elétrons?
Estudando os espectros de emissão de luz Bohr propôs a aplicação do modelo de Planck para explicar os espectros descontínuos de luz. Segundo Planck, a energia eletromagnética se propaga em pacotes de energia (o quantum, ou no plural, quanta).
Postulados de Bohr:
1º - O elétron move-se em órbitas circulares em torno do núcleo central
2º - Quando um elétron passa de uma órbita para outra, emite ou absorve energia
3º - Somente certas órbitas eletrônicas são permitidas ao elétron, que não emite ou absorve energia quando as percorre.
Ex.: H2O → Tfus = 0ºC; Teb = 100ºC; d = 1g/mL
Além disso, podem ser classificadas em:
Substâncias Simples - formadas por átomos de um mesmo elemento químico.
Ex.: Fe, N2, O3, P4...
Substâncias Compostas - formadas por átomos de mais de um elemento químico
Composto binário (dois elementos diferentes) – H2O e HCl
Composto ternário (três elementos diferentes) – NaOH e H2SO4
Composto quaternário (quatro elementos diferentes) – (NH4)2SO4
Uma característica principal das substâncias puras é a manutenção da temperatura durante a mudança de estado físico. Ao longo do processo de fusão e ebulição de uma substância pura a temperatura permanece inalterada, o que gera gráficos de temperatura x tempo característicos como o exemplificado abaixo. Lembre-se que durante a mudança de estado físico ocorre um equilíbrio entre as duas fases envolvidas (rever nota 1 da aula 1).
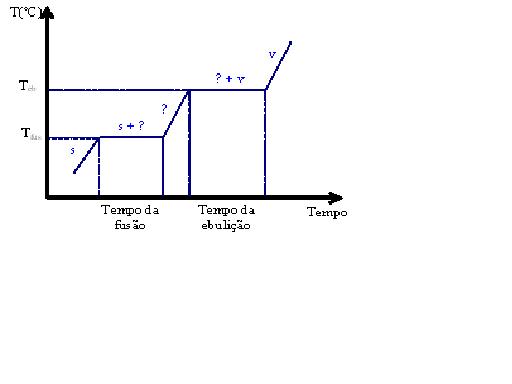
{{Mauro, por favor, me indique qual
é a figura correspondete a este trecho}}
- Misturas apresentam composição variável, mesmo quando conhecidas. Além disso, apresentam propriedades químicas e físicas que variam de acordo com a sua composição, não sendo portanto constantes.
As misturas podem ser classificadas em:
Mistura Homogênea - apenas um aspecto (fase) Ex.: água do mar
Mistura Heterogênea - mais de um aspecto (fase) Ex.: um copo de chopp
FASE - Cada porção homogênea de um sistema heterogêneo
Fique atento, pois a classificação de um sistema em homogêneo ou heterogêneo depende do instrumento ótico a ser utilizado. Assim, a olho nu, o sangue, o leite, a maionese, são misturas homogêneas, mas se olhados ao microscópio serão heterogêneas!!
Como apresentam propriedades que dependem diretamente de sua composição, as misturas não apresentam pontos de fusão e ebulição característicos como as substâncias puras, e sim faixas de fusão e ebulição. Dizemos então, que uma mistura funde entre 50 e 55ºC, por exemplo. Desta forma o gráfico de temperatura x tempo para uma mistura comum será diferente do de uma substância pura. Vejamos:
Reações Químicas
Considerações teóricas: Toda reação química é um rearranjo de átomos.
Em toda transformação química ocorre uma reação química que pode ser representada por uma equação química balanceada ou ajustada.
Em uma equação química são representados os reagentes antes da seta e os produtos após a seta.
Podemos dizer filosoficamente que uma reação química encerra em si a mutação e a permanência simultaneamente, pois como disse Lavoisier “nenhuma nova criação ou destruição da matéria está dentro do alcance da atividade química”.
Dessa maneira, em uma reação química a massa se conserva porque os átomos não são destruídos e, portanto a equação que a representa deve ser balanceada.
Balancear uma equação química é encontrar os coeficientes das substâncias que tornam o número total de átomos de cada elemento igual nos reagentes e nos produtos.
Os coeficientes são os menores números inteiros que ajustam a equação e representam a proporção em número de mols entre os participantes da reação.
Vamos representar a síntese do Aℓ2Br6:
Aℓ(s) + Br2 (l) à Aℓ2Br6(s) não balanceada
Para ajustá-la devemos igualar o número de átomos de cada elemento antes e depois da seta.
|
Aℓ reag |
Br reag |
Aℓ prod |
Br prod |
|
1 |
2 |
2 |
6 |
Basta multiplicar o Aℓ reagente por 2 e o Br regente por 3.
2 Aℓ(s) + 3 Br2 (l) à Aℓ2Br6(s) equação balanceada
Nota: Os índices s, l e g significam sólido, líquido e gasoso respectivamente e indicam o estado físico de cada substância. Há ainda a notação aq que significa em água ou aquoso.
Reações de síntese: são aquelas em que dois ou mais reagentes dão origem a um e somente um produto. Uma síntese muito importante é a síntese da amônia.
N2(g) + H2(g) à NH3(g) não balanceada
|
N reag |
H reag |
N prod |
H prod |
|
2 |
2 |
1 |
3 |
Como entre 2 e 3 o mínimo múltiplo comum é 6, devemos multiplicar o H reagente por 3 e o H produto por 2, consequentemente estaremos multiplicando também o N produto por 2, pois os coeficientes só podem ser introduzidos antes das fórmulas.
N2(g) + 3 H2(g) à 2 NH3(g) equação balanceada
Reações de Decomposição: são aquelas na qual um e somente um reagente se decompõe formando duas ou mais substâncias.
A decomposição térmica do carbonato de cálcio é um exemplo de reação de decomposição e pode ser representada pela seguinte equação já ajustada:
CaCO3(s) à CaO(s) + CO2(g)
Outra decomposição importante é a da água oxigenada que ocorre por ação da luz.
2 H2O2(aq) à 2 H2O(l) + O2(g)
Reações em solução aquosa: quando misturamos duas substâncias poderá ou não ocorrer reação entre elas. Quatro tipos importantes de processos provocam a ocorrência de reações quando os reagentes se misturam em solução aquosa.
a) Precipitação - forma-se um produto insolúvel, o precipitado.
Pb(NO3)2(aq) + 2 KI(aq) à PbI2(s) + 2 KNO3(aq)
O produto insolúvel PbI2 é indicado pelo estado físico sólido.
b) Reações ácido-base - nessas reações o íon H+ e OH- se combinam para formar água.
HNO3(aq) + KOH(aq) à KNO3(aq) + H2O(l)
As reações entre ácidos e bases fortes são denominadas de reações de neutralização, pois uma vez completada a reação, a solução restante é neutra.
Nota: Quando a amônia é um dos reagentes da reação, não devemos esquecer que a amônia é uma base e reage com a água formando o íon amônio e o íon hidroxila:
NH3(g) + H2O(l) à NH4(aq)+ + OH(aq)-
A reação da amônia com o HNO3 também é um exemplo de reação ácido-base, onde os íons H+ do HNO3 se combinam com os íons OH- produzidos pela reação da amônia.
NH3(g) + HNO3(aq) à NH4 NO3(aq)
c) Reações com desprendimento de gás – forma-se um produto que nas condições ambientes é um gás. Destacam se as reações com carbonatos que formam ácido carbônico (H2CO3) que se decompõe em gás carbônico (CO2) e água (H2O).
NiCO3(s) + 2 HNO3(aq) à Ni NO3(aq) + H2CO3(aq)
Como: H2CO3(aq) à CO2(g) + H2O(l) podemos escrever
NiCO3(s) + 2 HNO3(aq) à Ni (NO3)2(aq) + CO2(g) + H2O(l)
d) Reações de oxi-redução – nesse caso, o processo é a transferência de elétrons de uma substância parta outra.
Cu(s)0 + 2 Ag+NO3-(aq) à Cu2+(NO3)2-(aq) + 2Ag(s)0
Nesse caso o cobre (Cu) perdeu dois elétrons para a prata (Ag), sendo 1elétron para cada átomo de prata. Nessa reação os elétrons foram transferidos do cobre para a prata. Dizemos que a prata sofreu redução e o cobre sofreu oxidação.
Estequiometria
Definição:
Parte da Química em que se investigam as proporções dos elementos que se combinam em um composto ou dos compostos que reagem numa reação.
Divide-se em estequiometria de fórmulas e estequiometria de reações.
Decorre das leis ponderais de Lavoisier e Proust, isto é da lei da conservação da massa e da lei das proporções fixas e definidas. Através do cálculo estequiométrico é possível prever a quantidade de produto que será obtida em uma reação química.
A) Vamos começar nosso estudo por uma reação bem simples que é a síntese da amônia. A equação química que representa o fenômeno é
N2(g) + 3 H2(g) à 2 NH3(g)
De acordo com os nossos conhecimentos sobre as fórmulas podemos ler a equação acima da seguinte forma:
1 molécula de N2 reage com 3 moléculas de H2 para formar 2 moléculas de NH3.
Esta é uma leitura que se aplica ao mundo microscópico. Sabemos quase intuitivamente que se tivermos 10 moléculas de N2 serão necessárias 30 moléculas de H2 e se formarão, no máximo, 20 moléculas de NH3. Sabemos isso, pois a proporção em número de mols que rege a reação corresponde aos coeficientes da equação e é de 1: 3: 2.
No mundo macroscópico, não nos adianta relacionar moléculas, necessitamos de grandezas mais eficientes no cotidiano como a massa, o volume. A partir da proporção em número de mols é possível expressar a relação em massa entre reagentes e produtos e quando for interessante a relação em volumes.
Vamos reler a nossa equação acima introduzindo o conceito de mol, como o conjunto de 6,02×1023 elementos:
1 mol de N2 reage com 3 mols de H2 para formar 2 mols de NH3.
O que corresponde a:
6,02×1023 moléculas de N2 reagem com 3 × 6,02×1023 moléculas de H2 para formar 2 × 6,02×1023 moléculas de NH3.
Podemos fazer a mesma leitura em massa, sabendo a massa molar de cada participante da reação.
Temos N2 = 28 g/mol, H2 = 2 g/mol, NH3 = 17 g/mol e desse modo obteríamos:
1 mol × 28g/mol de N2 reage com 3 mol × 2 g/mol de H2 para formar 2 mol × 17 g/mol de NH3 , o que equivale a:
28 g de N2 reage com 6 g de N2 de para formar 34 g de NH3 .
Atenção: Não se deve confundir a proporção em número de mols com a proporção em massa. Essa última pode ser obtida da leitura acima e seria nos menores números 14 g de N2 reage com 3 g de H2 para formar 17 g de NH3.
Como nessa reação os reagentes e produtos estão no estado gasoso, supondo esses gases na temperatura de 0° C e pressão de 1 atm, o que significa condições normais de temperatura e pressão (CNTP), ainda poderíamos expressar a síntese da amônia pela relação entre os volumes de reagentes e produtos. Sabemos que nessas condições, 1 mol de qualquer gás ocupa 22,4 l e como sabemos o número de mols de cada participante na reação, podemos escrever:
1 mol × 22,4 l/mol de N2 reage com 3 mol × 22,4 l/mol de N2 para formar 2 mol × 22,4 l/mol de NH3, o que equivale a:
22,4 l de N2 reage com 67,6 l de H2 para formar 44,8 l de NH3 .
B) Observemos a equação global referente à transformação que ocorre no alto-forno para a produção de ferro gusa em uma siderúrgica:
2 Fe2O3(s) + 6 C(s) + 3 O2(g) à 4 Fe(s) + 6 CO2(g)
Considerando a equação anterior, o que aconteceria com a quantidade de ferro gusa produzida, se duplicássemos a quantidade de todos os reagentes?
Você deve ter pensado: duplicaria. Oh! E está certo.
Mas, se duplicarmos apenas o número de mols do Fe2O3, o que ocorrerá com a quantidade de matéria em mols de Ferro gusa produzida?
Se você respondeu que seria produzida a mesma quantidade, você acertou!
Da equação temos que 2 mol de Fe2O3 produzem 4 mol de Fe , porém se os demais reagentes não forem também duplicados, 4 mol de Fe2O3 continuarão produzindo 4 mol de Fe, pois a proporção da reação é mantida para qualquer quantidade de reagente.
Podemos fazer previsões sobre a quantidade de ferro que será obtida a partir de 320 kg de óxido férrico, considerando que os demais reagentes estejam em quantidades suficientes ou adequadas. Essa quantidade poderá ser expressa em massa ou em mols de ferro produzido.
- Vamos determinar primeiramente a massa de ferro que será obtida:
Da equação temos que 2 mol de Fe2O3 produzem 4 mol de Fe . A massa molar do Fe2O3 é 160 g/mol e a do Fe é 56 g/mol. Como o nosso problema é determinar a massa de Fe a partir da massa de Fe2O3, vamos escrever a relação acima em massa:
|
Se 2 mol × 160 g/mol de Fe2O3 |
produzem |
4 mol x 56g/mol de Fe |
|
quando tivermos |
|
|
|
320 Kg de Fe2O3 |
produziremos |
massa de Fe |

Ao cancelarmos as unidades só restará o kg e, portanto nossa resposta está em kg.
- Vamos agora determinar a quantidade de matéria em mols de Fe que seria obtida com 320 kg de Fe2O3.
Da equação temos que 2 mol de Fe2O3 produzem 4 mol de Fe . A massa molar do Fe2O3 é 160 g/mol e a do Fe é 56 g/mol. Como o nosso problema é determinar o número de mols de Fe a partir da massa de Fe2O3, vamos escrever a relação acima em número de mols para o Ferro e em massa para o a Fe2O3, de acordo com o que foi dado e o que é pedido:
|
Se 2 mol × 160g/mol de Fe2O3 |
produzem |
4 mol de Fe |
|
quando tivermos |
|
|
|
320 kg de Fe2O3 |
produziremos |
número de mols de Fe |
Número de mols de
para cancelar as unidades é necessário escrever 320
kg em g, uma vez que a massa molar é definida como g/mol.
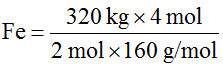
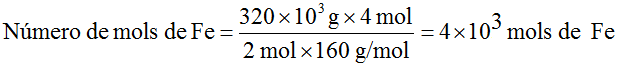
O resultado está de acordo com a primeira determinação, pois 4 × 103 mol de Fe é igual a 4 × 103 mol × 56 g/mol = 224 × 103 g ou 224 kg.
- Vamos ainda nesse processo determinar o volume de CO2 que seria obtido nas CNTP com 320 kg de Fe2O3.
Da equação temos que 2 mol de Fe2O3 produzem 6 mol de CO2.
A massa molar do Fe2O3 é 160g/mol e o volume molar do CO2 nas CNTP é de 22,4 l/mol. Como o nosso problema é determinar o volume de CO2 a partir da massa de Fe2O3, vamos escrever a relação acima em massa para o a Fe2O3 e em volume para o CO2, de acordo com o que foi dado e o que é pedido:
|
Se 2 mol × 160g/mol de Fe2O3 |
produzem |
6 mol × 22,4 l/mol de CO2 |
|
quando tivermos |
|
|
|
320 Kg de Fe2O3 |
produziremos |
volume de CO2 |
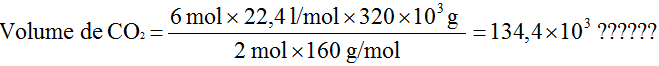
Cancelando as unidades, encontramos nossa resposta em litros, como é coerente com a grandeza volume. O volume de CO2 obtido a partir de 320 kg de Fe2O3, com os demais reagentes em quantidades suficientes será de 134,4×103 l.
Pela análise dimensional os itens anteriores são resolvidos de forma muito simples, com ênfase nas unidades:
Em primeiro lugar calcula-se o número de mols de Fe2O3 em 320 kg, isto é, 320x103g:
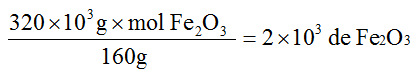
Como o número de mols de Fe é o dobro do número de mols de Fe203 temos 4×103 mols de Fe, o que corresponderá em massa a:
Massa de Ferro = número de mols de Fe × massa molar do ferro
Massa de Ferro = 4 × 103 mol de Fe × 56g/mol = 224 × 103 g de Fe
Como o número de mols de CO2 é o triplo do número de mols de Fe203, o que corresponderá em volume a:
Volume de CO2 = 3 × número de mols de Fe203 x volume molar nas CNTP
Volume de CO2 = 6 × 103 mol de CO2 × 22,4 l/mol = 134,4 x103 l
C) O fósforo queima no cloro gasoso com chama brilhante e produz o tricloreto de fósforo. A equação química do fenômeno é
P4(s) + 6 Cℓ2(g) à 4 PCℓ3(l)
Se a amostra de fósforo tiver uma massa de 1,45 g, qual seria a massa de cloro necessária para fazer todo o fósforo reagir?
Da equação temos que 1 mol de P4 reage com 6 mol de Cℓ2.
A massa molar do P4 é 124 g/mol e a do Cℓ2 é 71 g/mol. Como o nosso problema é determinar a massa de Cℓ2 a partir da massa de P4, vamos escrever a relação acima em massa:
|
Se 1 mol × 124 g/mol de P4 |
reagem com |
6 mol × 71 g/mol de Cℓ2 |
|
quando tivermos |
|
|
|
1,45 g de P4 |
Necessitaremos de |
Massa de Cℓ2 |
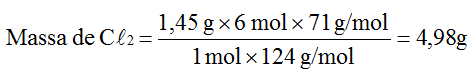
Com o auxílio da análise dimensional, calcula-se primeiro o número de mols de P4 correspondente a 1,45 g.
Como o número de mols de Cℓ2 é o sêxtuplo do número de mols do P4, isso equivale a 0.07 mol de Cℓ2 .
Massa de Cℓ2 = número de mols de Cℓ2 × massa molar do Cℓ2
Massa de Cℓ2 = 0.07 mol × 71g/mol = 4,98 g
-----------------------------------------------------------------------------------------------------------------